慢性肾脏病(chronic kidney disease,CKD)为全球重大非传染性慢性疾病之一,起病隐匿,早期常无症状,疾病进展过程中可出现贫血、高血压、矿物质骨代谢紊乱、心脑血管事件等多种并发症,部分患者就诊时已进入终末期肾病(end stage renal disease,ESRD)。我国CKD患病率为10.8%,面临数量庞大、知晓率低、诊治率低、医疗费用高的困境,疾病负担沉重[1]。对CKD实行早期筛查、早期转诊、下沉社区、分层管理,有益于延缓疾病进展、降低ESRD发生率,符合“健康中国2030”战略。
CKD筛查相对于肿瘤早期筛查起步相对较晚。21世纪初相关疾病专业组织建议对糖尿病、高血压患者进行CKD筛查。2012年美国预防服务工作组联合美国医生协会发表了关于CKD1~3期的筛查、检测及治疗指南,建议对不伴危险因素的人群进行系统筛查[2-3]。以上针对自然人群的CKD筛查建议后来被证实获益有限。
2019年改善全球肾脏病预后组织(kidney Disease:Improving Global Outcomes,KDIGO)在2012年CKD评估及管理临床实践指南基础上就CKD早期识别与干预发起了会议讨论,并于次年颁布了相关共识,建议为高危人群实施CKD筛查、分层和治疗,最好在初级或社区医疗机构进行,并根据当地情况进行调整[4-5]。我国目前尚未建立规范化CKD的早期筛查路径。为改善我国CKD面临的困境,CKD的早期筛查亟需在国内推广,以提高基层医生对CKD的早期识别能力。
为推动我国CKD筛查计划,2022年6月由四川大学华西医院慢性肾脏病管理中心牵头,依托多学科联合推进模式下CKD及其并发症管理项目联盟,组织中西部地区CKD管理专家,结合我国国情,针对初诊医生和基层医疗机构,提出了基于个体化筛查模式的《中国成人CKD及其并发症早期筛查临床路径专家建议》。本建议重点讨论CKD筛查的目标、概念与模式、筛查的目标人群、方法及频率、筛查后的诊断和评估、并发症的早筛路径。
1CKD筛查的目标
CKD筛查旨在让初诊或基层医生早期识别CKD高危人群,早期发现潜在CKD患者以及CKD并发症,早诊早治,降低发生率,延缓疾病进展。
2CKD筛查的概念与模式
1968年Wilson和Jungner起草的疾病筛查实践原则被视为疾病早期筛查的金标准[6]。随着医学技术的发展,疾病筛查的定义、内涵和模式不断更新完善。英国国家筛查委员会将筛查定义为一项公共卫生服务,即针对不认为自己有疾病风险、已患有疾病或相关并发症的特定人群,通过询问或检测以识别那些极可能获益的个体,让其通过进一步的检查或治疗更可能获益,以降低疾病或并发症风险[7]。目前疾病筛查模式有以下3种:基于人群的系统筛查、机会性筛查和个体筛查。前两者为经典的流行病学筛查,后者为新兴的概念化筛查。
2.1 基于人群的系统筛查 即自然人群筛查。以普通或自然人群为对象,多由国家或地区相关部门牵头实施,督促符合筛查条件的全体人群在规定的、相对集中的时间内根据标准化设计的方案进行筛查。其覆盖所有符合筛查条件的人群,流程实施严格规范,资源耗费较高,在疾病普查、早期癌筛查中应用。
2.2 基于人群的机会性筛查 即伺机筛查。由政府或卫生机构发起,在患者因其他原因就诊或咨询时,对无症状者,不经临床评估,提供筛查测试,以早期发现疾病或相关并发症。结构化的伺机筛查有政策支撑、医疗保险系统支持,广泛覆盖目标人群,通过各种检测手段完成并关注质量和监测结果,以美国的广泛结肠镜筛查为典型代表。
2.3 个体化筛查 又名病例发现。由临床医生发起评估,伺机向高危个体提供一项简短、恰当的初筛方法,包括问诊、查体及检查等,以早期发现疾病及相关并发症。其筛查手段选择灵活,无需额外资源支持,可能会忽略不常见或未知的疾病危险因素。个体化筛查已被国外指南推荐用于痴呆的筛查。
由于CKD起病隐匿、早期多无症状,理想的筛查模式是基于人群的系统筛查或机会性筛查,但需要政府和卫生系统组织投入,资源消耗大。作为中等收入国家,我国人口众多、地域辽阔、经济层次不齐、区间医疗资源分布不均。因此,本专家组建议广泛开展CKD个体化筛查模式,条件允许时针对CKD高发地区与结构化伺机筛查有机结合,有助于提高我国CKD的早诊早治率。
本建议将CKD的个体化筛查定义为以体检或就诊的个体为对象,依托乡镇或社区卫生院、体检中心、医院实施,由初诊临床医生发起评估,针对CKD高危个体选择筛查方法,以早期发现CKD和其相关并发症。不同于人群筛查,病例发现强调个体检查,是否进行检查取决于初诊临床医生的判断而非全员检查。因此,对初诊临床医生,特别是初级医疗、社区或全科医生,提供类似筛查指南的标准路径更为重要,以避免过度或过低的早期筛查。
3CKD筛查的目标人群
成人CKD早期筛查的目标人群是基于循证医学证据的我国CKD发生的高危人群。CKD新发的高危人群包括:老年(年龄≥65岁);来自社会经济落后或卫生医疗条件差的地区;肾脏病家族史;糖尿病;高血压;心脑血管疾病;高尿酸血症;肥胖;先兆子痫;长期服用可能影响肾脏的药物;长期吸烟者;长期暴露于特定的化学物品或环境中(高危职业或环境暴露);泌尿系统结石或梗阻性肾病;急性肾损伤病史;容易继发CKD的系统性或全身性疾病(如系统性红斑狼疮、血液系统肿瘤等);容易继发CKD的慢性传染性或感染性疾病(如人类免疫缺陷病毒、乙型或丙型肝炎病毒感染等);低出生体重;先天性泌尿系统发育异常(如孤立肾或尿路畸形);可能继发CKD的地区性疾病(如血吸虫、疟疾)。
4CKD新发的风险评估
CKD风险预测模型有助于评估CKD发生的概率。Nelson等[8]纳入包括北京在内的34个多中心队列研究,以年龄、性别、种族、基线估算肾小球滤过率(eGFR)、吸烟、体质指数(body mass index,BMI)、高血压、糖尿病、心血管疾病和尿白蛋白与肌酐比值(albumin-to-creatinine ratio,ACR)为自变量,确立了5年内发生CKD[eGFR<60 mL/(min·1.73 m2)]的风险预测公式(https: // ckdpcrisk.org/ ckdrisk/)。
5CKD早期筛查方法5.1 尿液筛查5.1.1 尿常规 蛋白尿和(或)活动性尿沉渣的初筛检测首选尿常规检查,应包括尿生化及沉渣镜检。鉴于尿常规对早期微量白蛋白尿[24 h尿白蛋白排泄率(albumin excretion rate,AER)30~300 mg/24 h]不敏感,本专家组建议留取清洁中段晨尿送检尿常规和ACR作为CKD早筛。
5.1.2 ACR 当随机尿液标本的ACR结果>30 mg/g(或3 mg/mmol)时,需于次日留取晨尿标本再行此项检查。临床医师需排除假性蛋白尿的影响因素,如未清洁留取的尿标本、尿路感染、前列腺炎、女性月经、妇科炎症影响等,必要时再次取样复核。
5.2 肾功能检测 血清肌酐和(或)血清胱抑素C检测。对于高龄老年、肌肉含量降低或过高、营养不良、肝功能障碍、截肢或神经肌肉疾病、合并影响肌酐排泄药物、高蛋白膳食或素食者,建议采用血肌酐联合血清胱抑素C的CKD-EPIcr-cyst公式评估GFR。
5.3 肾脏超声 对于经济相对发达、具备超声检查条件的初级医疗机构,泌尿系超声检查可作为CKD筛查的必要补充,有助于发现肾脏结构异常。
5.4 其他 无创早期筛查手段包括尿液视黄醇结合蛋白、α微球蛋白和β2微球蛋白等肾小管损伤标志物[9]。针对疑似遗传性肾病或具有肾病家族史的患者结合化验指标可进一步进行基因筛查[10-11]。
6CKD筛查频率
对于体检或就诊的个体,一旦发现伴有CKD发生的高危因素应立即启动相应筛查。2020年KDIGO共识提出建议对较大年纪人群进行筛查,但未明确具体起始年龄。上海市肾内科临床质量控制中心专家组在2022年版《慢性肾脏病早期筛查、诊断及防治指南》中提出对于65岁以上者,应启动CKD筛查[12]。
对于CKD高危人群,本专家组建议每6~12个月进行1次尿常规、ACR和肾功能检测,开展CKD防治知识的宣教。对于不伴CKD高危因素的人群,建议每年进行1次尿常规、ACR和肾功能检测。筛查开始时机、检测频率及终止时机应基于危险因素、患者意愿及预期寿命个体化调整。CKD早期筛查临床路径见图1。
(点击可查看大图↓↓)
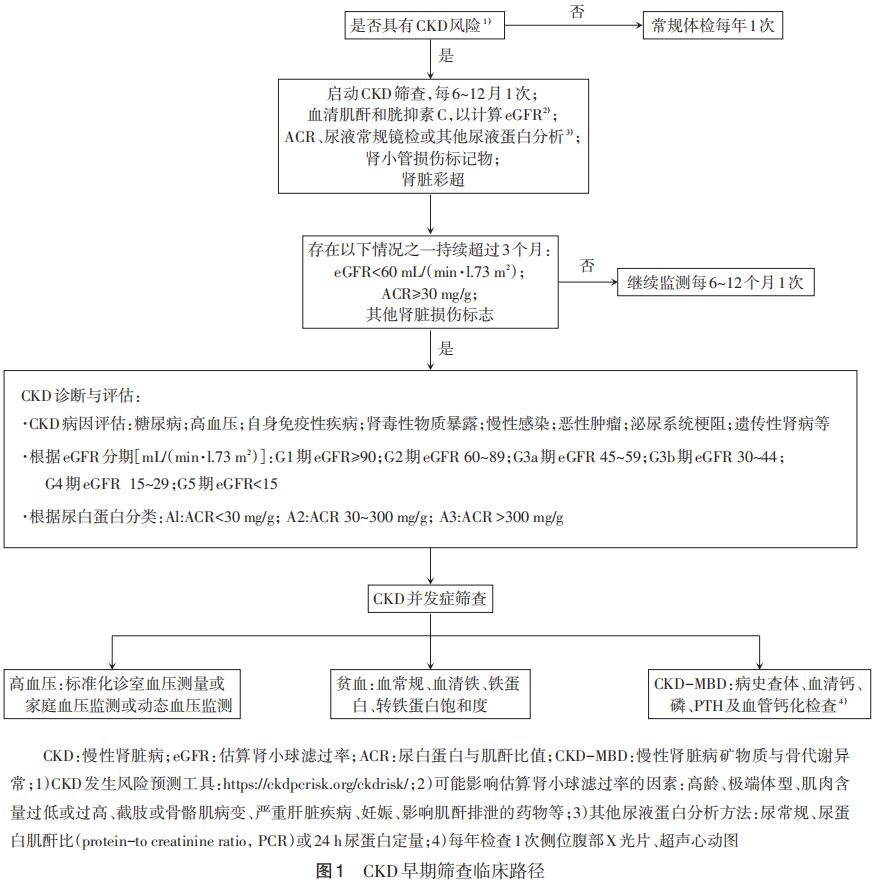
7CKD筛查后的诊断和评估
7.1 CKD的诊断 根据2012年KDIGO慢性肾脏病评估及管理临床实践指南,CKD是指肾脏出现损伤或功能异常持续3个月以上。肾损伤标志包括:(1)白蛋白尿(AER≥30 mg/24 h;ACR≥3 mg/mmol);(2)尿沉渣异常;(3)肾小管相关病变;(4)肾脏病理组织学异常;(5)泌尿系统影像学所见结构异常;(6)肾移植病史。肾功能异常是指GFR≤60 mL/(min·1.73 m2)。
7.2 CKD的评估
7.2.1 病因评估 包括个人史、家族史,有可能引起CKD的相关疾病史,社会及环境因素,药物服用史,既往体检结果,化验指标、影像检查、病理诊断。
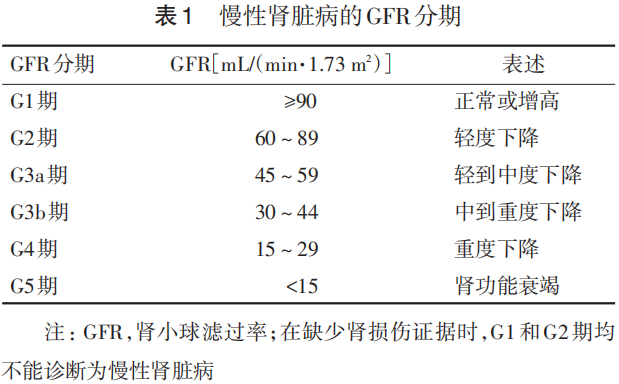
7.2.2 GFR评估及分期 本专家组建议应用血清肌酐、胱抑素C估算GFR公式进行分期,见表1。
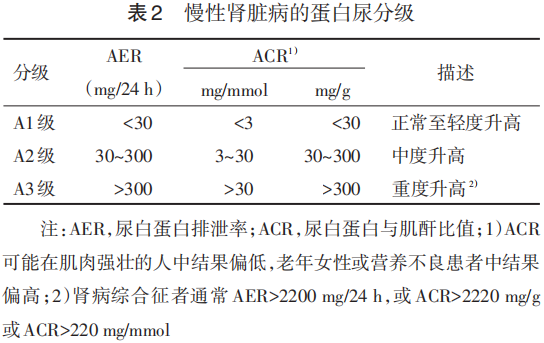
7.2.3 蛋白尿的评估及分级 本专家组建议采用ACR、尿蛋白肌酐比或24 h尿蛋白定量精确评估蛋白尿。2012年KDIGO指南推荐根据AER和ACR进行蛋白尿分级,见表2。
7.2.4 CKD的预后危险分层 2012年KDIGO慢性肾脏病评估及管理临床实践指南推荐根据eGFR和ACR对CKD进行危险分层,见表3。
8CKD并发症的早筛路径
经确诊的CKD患者应进一步进行相关并发症的筛查和评估。CKD并发症多样,本建议中主要关注相对隐匿且高发的CKD早期并发症,包括高血压、贫血和慢性肾脏病-矿物质和骨代谢异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)。
8.1 CKD高血压的早筛路径 高血压在我国非透析CKD患者中的总体患病率为44.2%~86.1%,并随着CKD进展而增加,是心力衰竭、心肌梗塞、脑卒中的主要危险因素[13]。其中肾性高血压是指因肾实质和肾动脉病变引起的血压升高,为继发性高血压的主要组成部分。CKD高血压的早筛临床路径见图2。
(点击可查看大图↓↓)
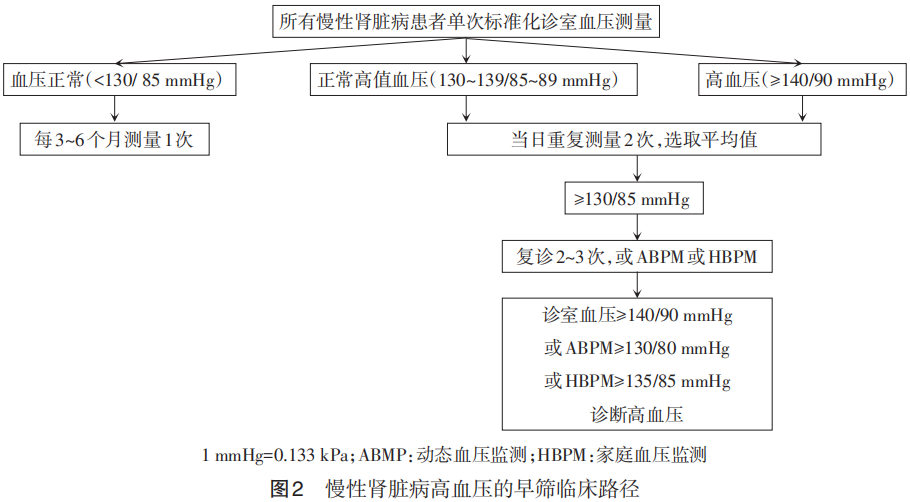
8.1.1 高危人群 所有CKD1~5期非透析、透析及肾移植患者。
8.1.2 早期筛查项目 (1)标准化血压测量,即采用标准化诊室血压测量,而非常规诊室血压测量。标准化诊室血压测量3次,每次间隔1 min以上,取后2次计算平均值。(2)建议采用家庭血压监测(home blood pressure measurements,HBPM)或动态血压监测(ambulatory blood pressure monitoring,ABPM)作为补充的诊室外血压测量方式。
8.1.3 筛查频率 目前关于成人CKD患者血压检测频率的证据有限,基于2020年美国预防医学工作组(US Preventive Services Task Force,USPSTF)成人高血压筛查共识及2021年KDIGO关于CKD患者高血压管理指南,建议:对于所有CKD患者,首次均应进行双上肢血压检测;初筛血压<130/85 mmHg(1 mmHg=0.133 kPa)的CKD患者,每3~6个月进行1次标准化血压测量;初筛血压>130/85 mmHg的CKD患者,间隔1~4周复诊检测血压,连续2~3次;或完善ABPM或HBPM帮助确诊高血压[14-15]。
8.1.4 诊断与评估 成人CKD患者高血压的诊断标准参照原发性高血压的诊断标准,即在未使用降压药物的情况下,非同日多次重复测量血压≥140/90 mmHg[16]。确诊高血压的成人CKD患者应进一步行以下评估:
(1)病史和查体:①排除其他继发性高血压:包括嗜铬细胞瘤、库欣综合征、原发性醛固酮增多症、甲状腺疾病、血管炎等;②排除药物引起的高血压:激素类、促红细胞生成素、交感神经兴奋剂(茶碱类、沙丁胺醇、特布他林等)、环孢素、他克莫司等;③评估心血管疾病的发生风险:左心室肥厚、心绞痛、心肌梗塞、心力衰竭等;④评估有无靶器官损害:脑血管(缺血性卒中、出血性卒中、短暂性脑缺血发作);高血压视网膜病变(出血、渗出、视乳头水肿);周围血管疾病等;⑤是否存在睡眠障碍、或肥胖(BMI≥27.5)等高危因素。
(2)辅助检查:血脂、血糖、12导联心电图、超声心动图。
(3)心血管事件风险分层:CKD3期及以上伴高血压为心血管事件高危或极高危人群。
8.2 CKD贫血的早筛路径 CKD患者贫血的病因包括肾性贫血、炎症反应或感染、继发性甲状旁腺功能亢进、营养不良、缺铁性贫血、溶血性贫血、出血性贫血、地中海贫血、再生障碍性贫血等血液系统疾病。其中肾性贫血被定义为各种肾脏疾病导致的红细胞生成素绝对或相对生成不足及尿毒症毒素影响红细胞生成及寿命而发生的贫血。CKD贫血的早筛临床路径见图3。
(点击可查看大图↓↓)
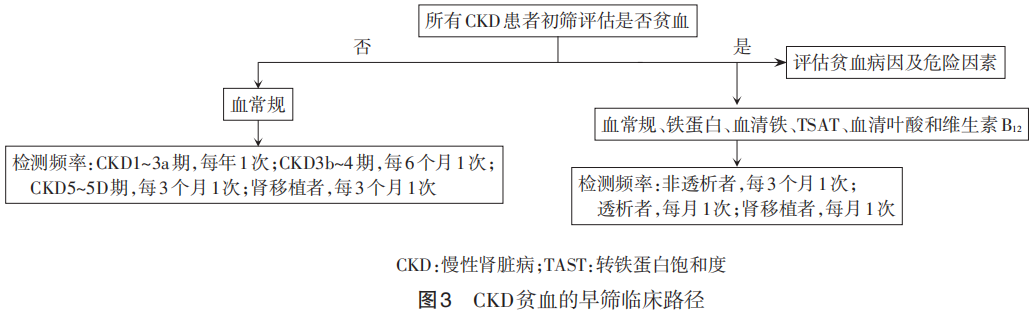
8.2.1 高危人群 所有CKD1~5期患者,特别是CKD3期及以上非透析、透析及肾移植患者。
8.2.2 早期筛查 (1)病史及查体:问诊原发肾脏疾病、乏力、痔疮、月经量、消化道出血史、近期感染病史、合并用药等。查体皮肤黏膜苍白等。(2)辅助检查:血常规、血清铁蛋白、总铁结合力、血清铁及转铁蛋白饱和度(tansferrin saturation,TSAT),血清叶酸和维生素B12。
8.2.3 监测频率 所有CKD患者首次筛查均应评估有无贫血。根据有无贫血及CKD分期进行分层实施检测频率。(1)无贫血的患者:CKD1~3a期,每年至少评估检测1次;CKD3b~4期,每6个月至少1次;CKD5期、腹膜透析、血液透析或肾移植患者,每3个月至少1次。(2)有贫血尚未启动治疗的CKD患者:非透析CKD患者,至少每3个月检测1次;透析及肾移植患者,每月检测1次。
8.2.4 诊断及评估 CKD患者中男性Hb<130 g/L,非妊娠女性Hb<120 g/L,妊娠女性Hb<110 g/L应诊断贫血[17]。同时需要考虑患者年龄、种族、居住地海拔高度的影响。对CKD3期及以上的贫血患者,应进一步系统性评估贫血的原因或加重因素[18-19]。
(1)除肾性贫血外,应排查是否合并引起贫血的其他病因:①营养不良:血清白蛋白、铁代谢及叶酸评估;②出血性贫血:询问痔疮病史;女性月经量;其他地方出血;大便隐血实验。③溶血性贫血:网织红细胞计数、抗人球蛋白(Coombs)实验、直接及间接胆红素、乳酸脱氢酶(LDH)等;④其他血液系统疾病:白细胞计数及形态、血小板计数、血清球蛋白、血尿游离轻链、骨髓穿刺及活检、血红蛋白电泳或基因检测等。
(2)评估是否加重肾性贫血的危险因素:①炎症状态:C反应蛋白(CRP)或超敏CRP;②感染:病毒、细菌或真菌等感染;③继发性甲状旁腺功能亢进:钙、磷及全段甲状旁腺激素(iPTH);④透析患者:透析充分性[尿素清除指数(kt/V),尿素下降率(URR)]及营养状况[蛋白氮呈现率(nPNA)、蛋白分解代谢率(PCR)];⑤肾移植患者:排斥反应、特殊病原感染(如人类微小病毒B19);⑥合并药物:可能影响骨髓造血或红细胞寿命的药物,如磺胺或免疫抑制剂。⑦药物抵抗:对于使用足量促红细胞生成素、铁剂仍贫血的患者,应排查促红细胞生成素抗体。
8.3 CKD-MBD早筛路径 CKD-MBD是由于CKD导致的矿物质及骨代谢异常综合征,临床上可能出现以下一项或多项表现:(1)钙、磷、PTH或维生素D代谢异常;(2)骨转化、矿化、骨量、骨线性生长或骨强度异常;(3)血管或其他软组织钙化[20]。
8.3.1 高危人群 CKD3a-5D期患者及肾移植患者。
8.3.2 早期筛查项目 (1)病史及查体:骨骼或关节疼痛、骨折、肌痛、肌无力、瘙痒、肾结石、软组织钙化、皮肤疼痛溃破等。(2)血生化指标:血钙、血磷、骨特异性碱性磷酸酶、甲状旁腺激素、25羟维生素D。(3)血管钙化:侧位腹部X光片(腹主动脉钙化)、超声心动图(心脏瓣膜钙化)。
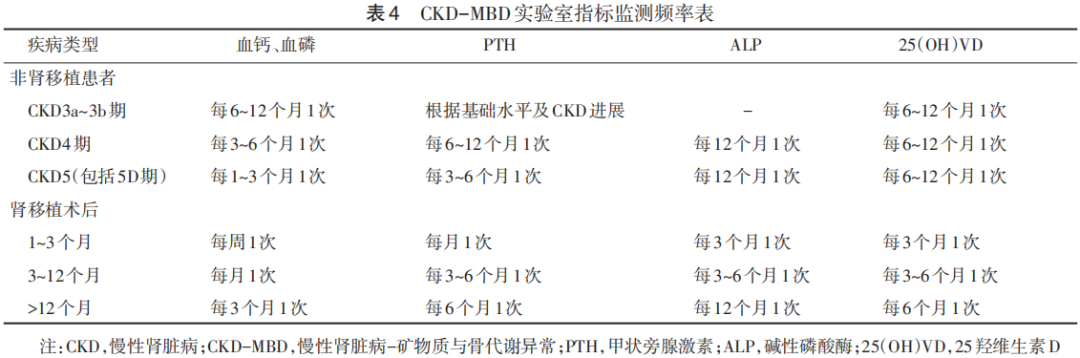
8.3.3 监测频率 (1)实验室指标:①非肾移植CKD患者:CKD3a~3b期,每6~12个月检查血清钙、磷水平,根据PTH基线水平和CKD进展情况决定PTH的监测间隔时间;CKD4期,每3~6个月检查血清钙、磷水平,每6~12个月检查PTH水平;CKD5期(包括5D期),每1~3个月检查血清钙、磷水平,每3~6个月检查PTH水平;CKD4~5D期,每12个月检查碱性磷酸酶活性;CKD3a-5D期,每6~12个月检查25羟维生素D水平。②肾移植受者:术后1~3个月,每周检查血清钙、磷水平,每月检查PTH水平,每3个月检查25羟维生素D水平、骨特异性碱性磷酸酶活性;术后3~12个月,每月检查血清钙、磷水平,每3~6个月检查PTH、25羟维生素D水平,每6~12个月检查骨特异性碱性磷酸酶活性;术后>12个月,每3个月检查血清钙、磷水平,每6个月检查PTH、25羟基维生素D水平,每12个月检查骨特异性碱性磷酸酶活性。
(2)骨病:①有CKD-MBD或骨质疏松高危因素者:每12个月评估1次骨密度;②有骨质疏松者:每6~12个月评估1次骨密度。
(3)血管钙化:每12个月检查1次侧位腹部X光片(筛查腹主动脉钙化)、超声心动图(心脏瓣膜钙化)。不同类型CKD患者实验室指标监测频率见表4。
(点击可查看大图↓↓)
8.3.4 诊断及评估 对存在CKD-MBD证据的患者:完善骨代谢指标、骨密度检查排查骨质疏松;进一步完善CT冠脉积分评估其他部位血管钙化;组织活检评估钙化防御;骨活检证实和鉴别骨骼病变。
9CKD及并发症早期筛查多学科联合管理流程
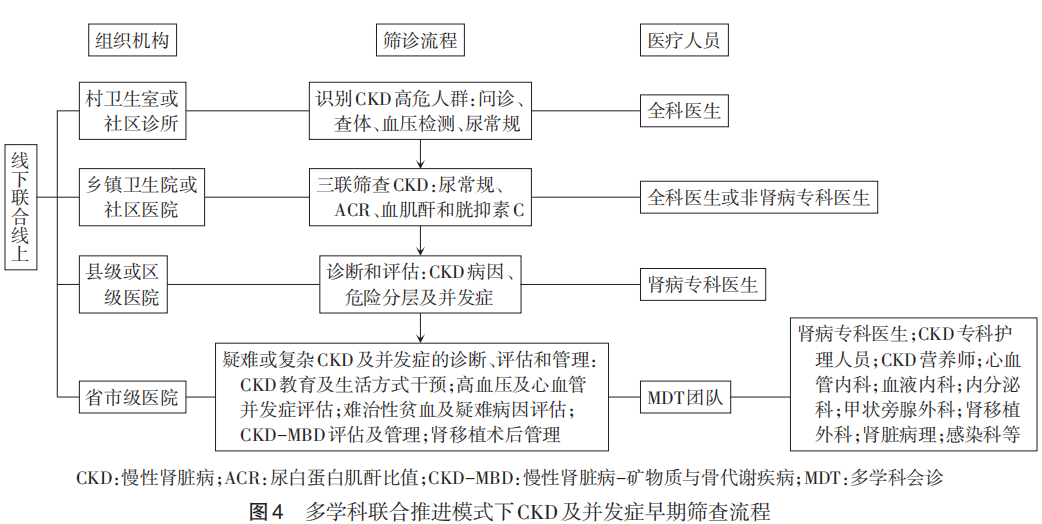
CKD早筛的有效开展,涉及筛查机构、人员构成及承上启下的组织管理。CKD及并发症的早期筛查需要下沉乡村、社区,主要是基层及非肾病专科医疗人员,如心内科、内分泌科、风湿免疫科、血液科等;筛查确诊后的管理评估也涉及多学科合作,如营养科、护理人员、甲状旁腺外科等。基于社区的早筛路径、分级转诊策略、多学科合作流程,有助于早期识别、早诊断、及时防止CKD进展及相关并发症。多学科联合推进模式下CKD及并发症早期筛查流程见图4。
(点击可查看大图↓↓)
10CKD早期筛查展望
CKD早期筛查在我国属于起步阶段。为确保利用有限资源高效地开展CKD的早期筛查,以下问题有待进一步研究:(1)我国不同民族间CKD发生及进展风险,是否与遗传、经济或卫生条件相关有待研究。(2)对于CKD筛查起始时机是否需要界定年龄有待进一步研究证实。儿童肾病涉及遗传或先天因素,老年患者肾脏生理功能衰老,预期寿命相对较短,建议针对儿童或老年CKD患者制定个体化筛查路径及诊断标准。(3)不同筛查模式有待随机对照试验或前瞻性队列研究比较获益与风险,以及经济学评价。(4)人工智能联合临床决策支持系统(clinical dicision supporting system,CDSS)在我国基层CKD早筛中的作用。(5)前瞻性研究建立中国CKD的风险预测模型,危险分层系统及筛查策略。